Dobór i ilość prób
Dobór próbek to kluczowy element badania. W przypadku badań serologicznych czy biochemicznych w większości interesuje nas liczba próbek i rzeczywiście jest to bardzo istotna sprawa. Często jednak decydujący jest dobór osobników czy grup osobników, od których pobrać próbki.
- Stawka jednorodna (ten sam wiek, ta sama grupa technologiczna – np. brojler)
Jeżeli mamy do dyspozycji stawkę zwierząt w jednym wieku to pozostaje problem precyzyjnego doboru zwierząt do próbkowania. Zwykle* próbkowanie dokonuje się w sposób losowy z terenu całego obiektu. Nie wolno sugerować się ich stanem klinicznym, eksterierem, wzrostem, wagą itp..
Uwaga szczególna - chore zwierzę łatwiej jest złapać. Nie popełniajmy błędu już na tym etapie.
PTAKI:
Przedstawiony poniżej schemat losowego doboru próbek z kurnika powinien być zawsze zachowywany, także w tych utrzymywanych w systemach klatkowych. Znane są sytuacje, w których do infekcji i rozwoju choroby dochodzi w określonych tylko obszarach obiektu. Wpływ na to ma zarówno mikroklimat i środowisko danej powierzchni (przeciągi, wilgotność, temperatura), ale także mobilność zwierząt. Znany jest fakt, iż nawet zwierzęta bez uwięzi (ptaki), poruszają się tylko w obrębie ograniczonego obszaru. Ptaki znają mniej więcej 400 innych osobników.

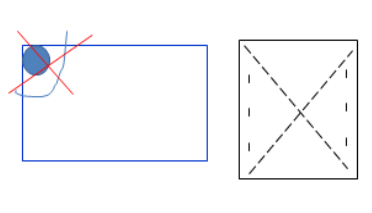
* Od powyższej reguły odstąpić możemy w przypadku:
1. doboru grup np. grupa ptaków chorych do porównania z grupą zdrową (zarówno do badań serologicznych jak i bezpośrednich np.PCR).
2. wyboru grupy ptaków z objawami – do badań bezpośrednich (PCR, bakteriologia, parazytologia etc.)
Jeżeli w gospodarstwie znajdują się dwa, nawet identyczne obiekty, próbkowania dokonujemy niezależnie w każdym z nich.
ZWIERZĘTA DUŻE, MOŻLIWOŚĆ ZNAKOWANIA, KOLCZYKI.
Losowy dobór prowadzony na prostej zasadzie. Oceniamy, że zgodnie z zasadami (lub po konsultacji z laboratorium) należy pobrać 16 próbek. Stado (np. loch) liczy 120 osobników. Zatem pobieramy od co 7-8 maciory (120 : 16 = 7,5).
Inny sposób to dobór w biurze. Losowo z listy zwierząt wybieramy założoną liczbę zwierząt do poboru prób.
* Od powyższej reguły odstąpić możemy tylko w przypadku:
1. wyboru grup. Np. loch w ciąży do porównania z lochami luźnymi, loch karmiących z lochami przed porodem itd. U krów w grupach przed porodem, 24-72 godz. po porodzie, w maksimum laktacji etc.
2. doboru zwierząt objawowych do badań bezpośrednich (bakteriologia, PCR, parazytologia, toksykologia, biochemia)
3. doboru grupy zwierząt po przechorowaniu do badań pośrednich (serologicznych).
Ten sposób wymaga jednak grupy kontrolnej (zwykle grupy z objawami).
4. Badania nakierowane. Np. do badania rozpoznawczego Leptospira dobieramy samice wykazujące zaburzenia w rozrodzie na dowolnym etapie ciąży (w tym nieregularne ruje). U bydła przy badaniu rozpoznawczym paratuberkulozy (PTBC) wybieramy osobniki z objawami powtarzającej się czy ciągłej biegunki, charłacze etc. Podobnie z Neospora (tu ronienia)
- Stawka niejednorodna
Nieco więcej problemów sprawia dobór próbek w stawce niejednolitej wiekowo (technologicznie), zwłaszcza jeżeli zamierzamy przebadać stawkę wielokierunkowo. Np. aby w chlewni zorientować się w sytuacji PRV najlepiej przebadać grupę macior, względnie tuczników, ale jeżeli interesuje nas aktualny problem MPS to najodpowiedniejsza będzie grupa 10-12 tyg. warchlaków, a przy APP tuczników itd.
Zasady doboru osobników do badań identyczne jak powyżej, tyle tylko że każda grupa wiekowa czy technologiczna próbkowana jest oddzielnie.
Przy pojawiających się wątpliwościach warto skontaktować się z laboratorium.
- liczba próbek
Jeden z najbardziej kontrowersyjnych tematów związanych z badaniami laboratoryjnymi. Wynika to ze słabej znajomości rachunku prawdopodobieństwa wśród hodowców czy lekarzy weterynarii.
Prosty przykład. Kule czarne i białe zmieszane pól na pół. Wydaje się, że jeżeli pociągniemy dwie kule to wśród nich powinna się znaleźć kula czarna. W rzeczywistości mamy na to tylko 75% szans, jeżeli pociągniemy trzy to nasza szansa rośnie do 87% jeżeli cztery to 94%, a pięć 97%. W biologii powinniśmy zakładać przedział ufności wynikający z prawdopodobieństwa na poziomie 95-96%. Gwarantuje on, że uzyskane wyniki w pełni można ekstrapolować (odnieść) na całą stawkę.
W doborze liczby próbek do pewnego stopnia, istotną rolę odgrywa wielkość stawki zwierząt, dlatego dzielimy je na dwie grupy: mało liczne (do 300 osobników)
Im mniejsza stawka zwierząt tym większą rolę odgrywa (w matematyce = waży) jeden osobnik. Przy 10 szt. – jeden osobnik to 10% stada. Przy 300 już tylko 0,3 % a przy 10 000 – 0,01%.
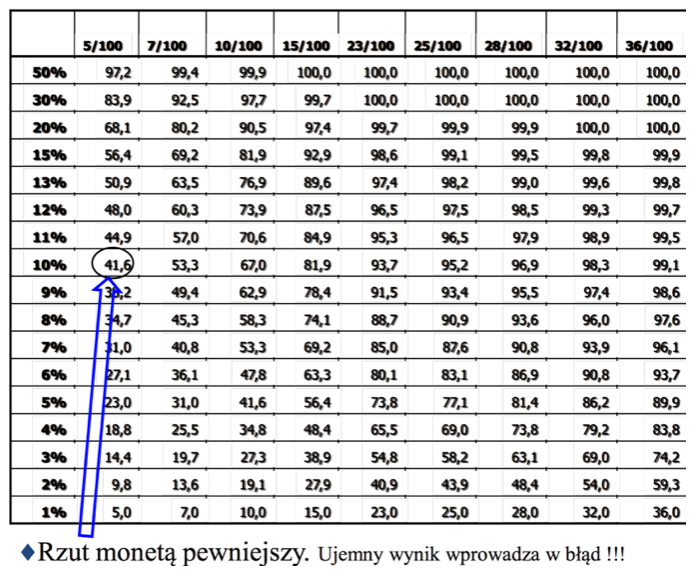
Poniższa tabelka pomoże nam w zorientowaniu się, jaka liczba próbek jest potrzebna do badań, aby chociaż w jednej z pobranych próbek pojawił się wynik dodatni (stawka liczy 100 osobników).
Trochę przybliżenia.
W stadzie liczącym 100 szt. staramy się wykryć czy przewinęła się tam np. salmonella i chcemy dokonać analizy serologicznej. Pobieramy zatem 5 próbek ze stada. Wszystkie wyniki ujemne. Czy w tej sytuacji uprawniony jest wniosek, że w stadzie tym nie ma salmonellozy ?
Zanim odpowiemy na to pytanie przytoczę krótką historyjkę przemawiającą do wyobraźni bardziej niż rachunek prawdopodobieństwa.
Mamy stado 100 ptaków w tym 10 kogutków (10%). To nasze stado i wiemy o tym. Zdarzyło się, że przybyli goście na późną i niezapowiedzianą kolację. Aby sprostać sytuacji wysyłamy syna aby odłowił jednego z kogutków. Ten poszedł i wrócił z wiadomością, że w kurniku nie ma kogutków bo po omacku złapał 5 ptaków, wyniósł na zewnątrz i wśród tych pięciu ptaków nie było koguta.
Teraz wróćmy do analizy problemu. 5 kogutków to nasze 5 prób surowic. Strzałka wskazuje prawdopodobieństwo znalezienia choćby 1 próbki dodatniej (wśród pięciu przez nas wybranych) przy 10% odsetku osobników seropozytywnych w stadzie. Prawie 42%. Oznacza to, że rzut monetą byłby pewniejszy !!. Pobór 15 próbek daje ponad 80% szansę na wykrycie choćby jednej dodatniej.
Przy podejmowaniu decyzji o liczbie próbek musimy mieć zatem na względzie rachunek prawdopodobieństwa. Musimy także znać tempo rozprzestrzeniania się schorzenia w stadzie. Np. PRRS czy BVD ogarnia zwykle > 80% pogłowia. W tej sytuacji może wystarczyć i 5 próbek. Częściej jednak prewalencja schorzenia jest niższa. Podobnie, na samym początku schorzenia w stadzie (badanie rozpoznawcze) także musimy posiłkować się dużą liczbą próbek, aby trafić na wynik pozytywny.
liczne (powyżej 300 osobników)
W dużych populacjach liczenie oparte jest o nieco inne podstawy statystyczne. Założenie pozostaje to samo - 96% ufności. Tu podaję jedynie wynik końcowy w postaci tabelki.
| prewalencja na poziomie | 1% | 2% | 3% | 5% | 8% | 10% | 12% | 14% | 16% | 18% | 20% | 30% | 50% | 60% |
| ilość próbek niezbędna do wykrycia | 322 | 161 | 107 | 64 | 40 | 32 | 27 | 23 | 20 | 18 | 16 | 11 | 6 | 5 |
Przykład. Aby wykryć zakażenie (nosicielstwo), które w stadzie przejawia się na poziomie np. 3% konieczne jest pobranie 107 próbek. Wielkość stada w tym przypadku dowolna, nawet >10 000 szt.
Schematy poboru i doboru prób
Przed poborem próbek warto przeanalizować schematy poboru próbek. Cel badania wyznacza zarówno liczba próbek jak i ich dobór.
1. Kontrola statusu zdrowotnego stada
- monitoring – stałe, okresowe kontrolowanie wybranych parametrów
system badania zwykle stosowany przy okresowych badaniach kontrolnych.
- chorób podlegających obowiązkowi zwalczania lub podlegających obowiązkowi rejestracji (w gestii PIWet.)
- chorób zwalczanych lub kontrolowanych w obrębie stada (badania właścicielskie - wiele hodowli stawia na stada wolne od PRRS, Mhp, ZZZN (trzoda), BVD, IBR, PTBC, Neosporoza (bydło), Arteritis (konie) czy innych jednostek.)
Badania monitoringowe można prowadzić zarówno w:
- metodach bezpośrednich (PCR, bakteriologia, parazytologia, biochemia)
- stan metaboliczny stada (badania biochemiczne mające na celu ocenę np. niedoborów, odżywienia, bilansu energetycznego, wskaźników wątrobowych, wskaźników toksemii itp.)
- parazytologia (istnieją także techniki serologiczne)
- parametry w nadzorze jak np. pozostałości leków, metali ciężkich czy pestycydów. Także Salmonella, Campylobacter etc.
- parametrów związanych z jakością paszy, wody, produkcją – np. mikotoksyny, białko, energia itp.
- kontroli środowiskowej (ocena mikrośrodowiska, kontrolne badania po odkażalniach itp.)
- pośrednich (głównie badania serologiczne)
- status immunologiczny wybranych jednostek chorobowych (kontrola prewalencji lub kontrola obecności). Kontrola obecności wybranego patogenu wymaga zwykle poboru większej liczby próbek aniżeli kontrola prewalencji
2. ocena statusu immunologicznego stada
Ma na celu stwierdzenie obecności przeciwciał dla jednej lub kilku jednostek chorobowych w poddanej badaniu stawce zwierząt. Celem jest nie tyle bezpośrednia diagnostyka aktualnego schorzenia, a raczej zorientowanie się w ogólnej sytuacji zdrowotnej stada (w tym odporności poszczepiennej) z myślą o dalszej profilaktyce i prewencji w tym stadzie lub następnych wsadach.
Znajomość statusu immunologicznego pozwala na:
- uzyskanie informacji o statusie zdrowotnym stada
- własnego
- z zakupu (remont stada)
- do sprzedaży (obrót)
- pośrednie potwierdzenie lub wykluczenie obecności patogenów w stadzie (badanie wielokierunkowe),
- pośrednie potwierdzenie obecności wybranego patogenu w stadzie (jeżeli to możliwe, z oceną czasu zainfekowania) – badanie jednokierunkowe.
- ocenę poszczepienną stada matecznego, potomstwa z oceną rozrzutu wyników,
- określenie czasu spadku przeciwciał biernych czy czynnych.
- pomocne w decyzji podejmowania dodatkowych szczepień stad matecznych.
- ustalaniu terminów szczepień potomstwa (pisklęta, oseski).
- kontrolowanie procesu szczepień (laboratoryjna ocena efektywności na podstawie odpowiedzi immunologicznej).
ocena statusu immunologicznego stada w profilu wiekowym, technologicznym
Niekiedy po określeniu statusu immunologicznego zachodzi potrzeba szczegółowego dookreślenia momentu zakażenia, oceny czasu spadku odporności biernej, określenia grupy wiekowej lub technologicznej, w której dochodzi do zakażeń itd. W tym celu pobierane są próbki od grup zwierząt w różnym wieku lub z różnych grup technologicznych. Badanie przeprowadzone jest jednorazowo z ukierunkowaniem na jeden lub kilka parametrów. Porównanie mian (lub innych wartości) poszczególnych grup wiekowych lub technologicznych daje odpowiedź, kiedy np. zanikają przeciwciała bierne, w których grupach dochodzi do rozwoju schorzenia, stabilizacji. Tego typu badania niezbędne są przy określeniu sposobów i terminów zabiegów prewencyjnych, profilaktycznych, a także sposobu zarządzania stadem.
Należy nadmienić, iż badania z określeniem profilu to nie tylko badania serologiczne, ale i bakteriologiczne czy biochemiczne, a nawet parazytologiczne.
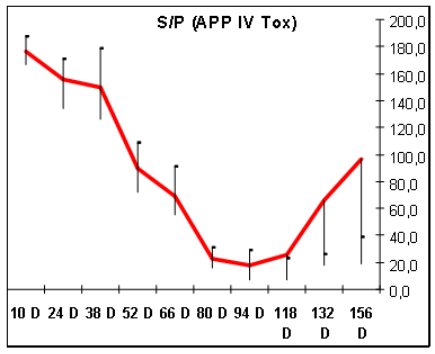
Ryc. 1 przedstawia przykład wielokierunkowego (dość skomplikowanego na pierwszy rzut oka) wyniku badania w profilu wiekowym (badania serologiczne oraz biochemiczne). Przykład pochodzi z rutynowych badań mających na celu ustalenie przyczyn schorzeń o ciężkich przebiegach wraz z oceną postępowania prewencyjnego.
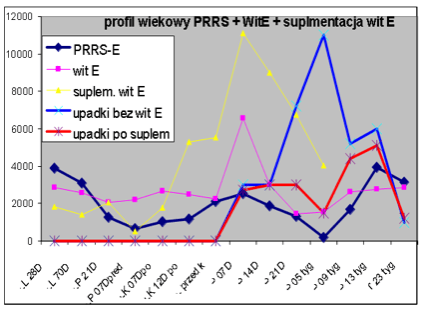
Ryc. 2 przedstawia prosty przykład profilu wiekowego, w którym ocenie poddano tempo spadku przeciwciał matczynych oraz obserwowano moment pojawienia się przeciwciał czynnych (po zakażeniu). Analiza danych pozwala nie tylko na ustalenie optymalnego terminu rozpoczęcia szczepień, ale także na analizę i korektę zarządzania stadem.
Formy doboru próbek:
1. okresowe lub jednorazowe badanie pełne, czyli badanie całego stada (pasz, surowców itp.).
a. najczęstszym uzasadnieniem takiego postępowania jest wykrycie i natychmiastowa eliminacja wszystkich osobników (lub elementów, partii, pasz, surowców itp.) posiadających cechy niepożądane (np. Neosporoza, Ptbc czy Q u bydła).
2. screening (ekranowanie, badanie przesiewowe) okresowe badanie niepełne, polegające na losowym doborze próbek z puli całej stawki zwierząt lub z partii paszy, surowca.
a. Jest to najczęstsza forma badań monitoringowych
I. formy badań urzędowych określone są odrębnymi przepisami (w tym np. częstotliwość, liczba próbek, rodzaj próbek)
II. formy pozaurzędowych badań kontrolnych uzależnione są nie tylko od wiedzy i zaleceń lekarza, ale także od woli właściciela (PŁATNIK !!). Określenie np. częstotliwości badań nie jest łatwe - należy brać pod uwagę wirulentność, grupy wiekowe, grupy technologiczne, zagrożenie fermy, historię schorzenia na fermie, bioasekurację, kontakty, zakupy, zarządzanie stadem itp. Przyjęcie kontroli w odstępie półrocznym to zwykle zbyt ryzykowne postępowanie.
3. badanie środowiskowe
- na fermie (badania jakości powietrza, temperatury, wilgotności, przepływu itp.)
- pobranie wymazów środowiskowych chlewni, próbek otoczenia chlewni, próbek obornika,
ściółki, ścieków itp.
Uwaga: badanie środowiska fermy (np. kontrola po dezynfekcji) wymaga wypracowania schematu postępowania np. określenie powierzchni wymazu, wybranie miejsc pobierania wymazów powierzchniowych, ustalenie miejsca pobierania wymazów punktowych (szczelin, miejsc trudno dostępnych), także doboru próbek objętościowych (kurz, ścieki, gleba, ściółka itp.). Zalecałbym wypracowanie systemu pod kontrolą osoby doświadczonej w temacie.
2. Schorzenia bieżące – wykrywanie przyczyn (badania rozpoznawcze)
- Poszukiwanie przyczyn bieżącego schorzenia
Badanie ma celu identyfikację czynnika etiologicznego. Zwykle ograniczamy się do poszukiwania czynnika zakaźnego jednak brać pod uwagę należy badania biochemiczne, toksykologiczne czy środowiskowe.
- metody bezpośrednie
- bakteriologia, parazytologia, izolacja wirusologiczna,
- stwierdzenie obecności materiału genetycznego – testy PCR
- badania biochemiczne
- stwierdzenie obecności czynnika toksycznego - przy podejrzeniach mikotoksyn zaleca się kontakt z laboratorium.
- badania środowiskowe
- badanie pasz i wody
Stwierdzenie patogenu (lub innych czynników) metodami bezpośrednimi w sposób jednoznaczny potwierdza jego obecność w stadzie. Nie zawsze stanowi to o jego roli w toczącym się procesie chorobowym. Np. przy okazji badań przyczyn ciężkich schorzeń płucnych u trzody izolowano Actinobacillus pleuropneumoniae serotyp-9, a nadto Salmonella Enteritidis. O ile rola APP-9 jest jednoznaczna to o salmonelli możemy w tym przypadku mówić jedynie jako nosicielstwie, a nie bezpośredniej przyczynie schorzeń płuc.
Podobnie rzecz się ma w ocenie wyników otrzymanych w PCR. Klasyczna technika określa czy patogen jest czy go nie ma, bez określenia jego ilości. W technikach Real Time PCR wynik podawany jest także półilościowo (CT) lub ilościowo – w odniesieniu do wzorca. W tym przypadku wiemy czy badany czynnik jest w próbce w wysokiej koncentracji czy tylko jest obecny.
UWAGA: im niższe CT tym wyższa koncentracja materiału genetycznego!
CT= cykl w którym ujawnia się wynik pozytywny. Jeżeli np. w jednej z próbek CT=18 a drugiej 26 oznacza to, że w drugiej próbce jest 256x mniej materiału genetycznego niż w 1-szej.
W badaniach w technikach bezpośrednich bardzo istotny jest czas od wybuchu schorzenia do podjęcia decyzji o pobraniu próbek. Im krótszy – tym wynik badania pewniejszy.
- metody pośrednie
Z założenia nie wykrywa się obecności patogenu, a ślad który pozostawił w postaci przeciwciał. Pojawiają się one najwcześniej w 10 dni od rozpoczęcia schorzenia (zwykle później). Zatem analizując przyczynę aktualnie toczącego się procesu musimy o tym pamiętać.
- serologiczne
- badanie jednokrotne
w poszukaniu przyczyn schorzeń może to być bardzo niepewna metoda. Bardzo prosty przykład. W poszukiwaniu czynnika zakaźnego bieżących schorzeń płuc zdecydowano o podjęciu badań serologicznych w kierunku APP. Otrzymano wynik ujemny. Pomimo takiego wyniku nie wolno jednak wykluczać roli APP. Wykrywalne poziomy przeciwciał pojawiają się najwcześniej w 10 dni od rozpoczęcia choroby (a nawet po 3 tyg). Powtórne badanie (po kilku dniach) przyniesie wynik DODATNI. Jeżeli powtórne badanie wykonano w innym laboratorium, całą winę składa się na niekompetencję laboratorium wykonujące pierwsze badanie. NIESŁUSZNIE.
W podjęciu decyzji o badaniu jednokrotnym należy uwzględnić czas pojawienia się schorzenia. Jeżeli jest on > 10 dni – ten rodzaj badania jest uzasadniony. Jednak liczba próbek musi być wystarczająco duża (patrz dobór liczby próbek).
- badanie grup (zwykle 3 grupy: przed chorobą, w trakcie i po) – pobór próbek w jednym dniu
zdecydowanie precyzyjna droga do rozpoznania przyczyn schorzeń.
Ten rodzaj badania jest uzasadniony w stadach, gdzie schorzenie stwierdzone jest endemicznie lub przynajmniej > 2 msc. Oczywiste jest także, że w stadach z obecnością różnych grup wiekowych istotne jest bardzo precyzyjne dobranie grup zwierząt i opis próbek. Drobny błąd w postaci przemieszczenia jednego zwierzęcia z grupy do grupy prowadzi do błędów nieprawidłowego „odczytania” statusu stada.
- badanie par surowic.
Ten typ badania można zastosować w stadach, gdzie zaczął się proces chorobowy lub przebieg schorzenia nie jest gwałtowny.
Niewątpliwie bardzo precyzyjna i na pewno jednoznaczna metoda. Jej wadą jest czas oczekiwania na ostateczny wynik. Badanie polega na próbkowaniu tych samych zwierząt (lub grupy zwierząt – zwłaszcza ptaków) w odstępie 2 tyg. Często zatem wynik ten ma znaczenie historyczne.
1. Ssaki (lub zwierzęta, które można trwale oznaczyć):
Do pierwszego pobrania próbek typuje się zwierzęta wykazujące objawy chorobowe, pobiera próbki, opisuje próbki numerami zwierząt. Po 10 dniach – 2 tyg. pobiera się próbki od dokładnie tych samych zwierząt.
2. Ptaki (lub zwierzęta, których nie można trwale oznaczyć):
Zasada – stada na początku schorzenia. Pobiera się absolutnie losowo próbki (> 23 ), pamiętając, że chory ptak nie ucieka i łatwiej go schwytać.
Po 10 dniach – 2 tyg. – próbki pobieramy na identycznych zasadach.
UWAGA: istnieją jednostki chorobowe (patrz bydło), gdzie okres inkubacji jest dość długi, a jednocześnie okres półtrwania przeciwciał krótki (np. BRSV). W efekcie przy badaniu par surowic trzeba szczególną uwagę poświęcić doborowi zwierząt, a następnie ostrożnie interpretować otrzymane wyniki.
Dość często w badaniach rozpoznawczych młodych zwierząt dochodzi do nieuwzględniania obecności przeciwciał matczynych (siara, żółtko). Z rozpędu poddaje się badaniu serologicznemu młode osobniki, które przechorowały a nie uwzględnia się ich odporności biernej. W takich sytuacjach zaleca się badanie metodami bezpośrednimi (PCR, mikrobiologia). Badania serologiczne warto prowadzić po zaniku przeciwciał matczynych.
Niedoceniana jest także technika pobierania krwi przedsiarowej – ocena zakażeń płodowych.
Uwagi ogólne
Lekarz weterynarii jest nie tylko doradcą hodowcy - w większości przypadków jego decyzja (opiniotwórczość) waży o skuteczności postępowań weterynaryjnych. Wywiad, badanie kliniczne oraz anatomopatologiczne to pierwszy etap oceny statusu zdrowotnego. Dla większości hodowców i lekarzy obiektywnym wsparciem rozpoznania i elementem rozstrzygającym są badania laboratoryjne. Ciągle jeszcze pozostaje grupka hodowców i niestety lekarzy weterynarii, którzy nie doceniają znaczenia badań laboratoryjnych lub mają złe doświadczenia, kiedyś nie spełniły się ich oczekiwania w stosunku do wyników. Są i tacy, dla których wcale nie jest łatwe ustalenie, jaki materiał nadaje się do badań lub też sam wynik jest zbyt zawiły – a przyznać należy, że wydruki komputerowe, niekiedy w języku obcym, tabele liczb, niezrozumiałe pojęcia, zagadkowe skróty, nadmiar danych proceduralnych itp. nie ułatwiają zadania.
Laboratorium powinno być w stanie pomóc w usystematyzowaniu kierunków badań, ale co najważniejsze po ich zakończeniu powinno być pomocne w końcowej interpretacji wyników . Nie może dziwić, że lekarz klinicysta pozbawiony wsparcia merytorycznego laboratorium często nie daje sobie rady z zawiłościami technik laboratoryjnych, specyfiką testów, oceną wszystkich elementów wyniku, jego procedur itp. Laboratorium chcące kooperować w aktywny sposób z lekarzem i być pomocne w rozwiązywaniu problemów fermy, nie może ograniczać się do wydania „suchego” wyniku (chyba, że dotyczy to badań urzędowych), musi być przygotowane z jednej strony do udzielania wszelkich informacji wspomagających interpretację wydanego wyniku, a z drugiej do podpowiedzi w zakresie próbkowania, ukierunkowania badań oraz wskazania warunków zabezpieczenia próbki i jej transportu. Bardzo istotnym jest, aby laboratorium określiło wpływ powyżej wymienionych elementów na końcowy rezultat. W laboratoriach, które w zakresie dobrej praktyki laboratoryjnej przyjęły aktywne wspomaganie klienta, już w trakcie prowadzenia badań (przed wysłaniem końcowego raportu) na bieżąco konsultuje się ewentualne korekty zakresów badań.
Zastanawia, że nadal postępowania „w ciemno” bez wsparcia badań laboratoryjnych są jeszcze spotykane. Niestety lekarz weterynarii nie do końca decyduje o kierowaniu próbek do badań. Hodowca jako płatnik – może odmówić, chyba nie do końca zdając sobie sprawę, iż wskutek tego za wszystkie niepowodzenia terapii (i te doraźne i te długofalowe) płaci on sam. W krajach zachodnich oczekuje się, że diagnozę lekarza nawet jeżeli jest ona jednoznaczna, potwierdza się w laboratorium. Wynik badania jest podstawą kontynuowania postępowania lub też jest podstawą zmiany procedury. Zatem warto byłoby może przyjąć te zasady, które zostały sprawdzone i które są rutynowymi praktykami.
Poprzez badania laboratoryjne uzyskać można wiele informacji, ale użyteczne będą tylko te z nich, które stanowią podstawę dalszej decyzji. Ukierunkowanie badań należy zatem przeprowadzać w sposób przemyślany tak, aby wyniki dały nie tylko odpowiedź na postawione pytanie, ale przede wszystkim aby było to pomocne w konkretnym rozwiązywanym problemie. Prosty przykład: analizując problem niepłodności, w kierunkach badań wskazano między innymi mykoplazmozę. Laboratorium udzieli odpowiedzi na to pytanie, ale czy przybliży nas to do rozwiązania problemu niepłodności? Pamiętać trzeba o fundamentalnej zasadzie - badanie laboratoryjne zaczyna się już w kurniku, oborze czy chlewni – i składa się z trzech części: po pierwsze jest to dobór i pobór próbek, bowiem jest nieodwracalny i ma decydujące znaczenie, co do możliwości podjęcia badań i późniejszej interpretacji wyniku. Następnie zabezpieczenie i transport próbek. Wreszcie – ustalenie zakresu badań - próbka po dotarciu do laboratorium będzie badana w żądanym kierunku co stanowi później bazę, na której hodowca i lekarz opierać będą dalsze postępowanie.
Pryncypialnym zadaniem jest zatem trud postawienia sobie pytania "jaki jest cel badania (co stanowi kluczową informację?) i jaką decyzję na tej podstawie jesteśmy w stanie podjąć?". Musimy przewidzieć czy otrzymany rezultat (zwłaszcza nieoczekiwany) umożliwi nam podjęcie decyzji. Zwykle po otrzymaniu wyniku niezgodnego z naszymi oczekiwaniami raz jeszcze znajdziemy się na początku rozwiązywania problemu, tracąc przy okazji cenny czas oraz próbki. Warto zatem od razu poczynić pewne założenia i tak prowadzić rozpoznanie, aby mieć możliwość manewru. Np. rozwiązujemy problem pokarmowy z podejrzeniem o kokcydiozę. Przesyłamy wycinki jelit czy kał. Otrzymując wynik ujemny, analizę problemu zmuszeni jesteśmy zaczynać od nowa. Natomiast, zakładając od początku taki obrót sprawy, w piśmie przewodnim należałoby zastrzec zachowanie powierzonej próbki. W tej sytuacji wystarczyłoby dodatkowe zlecenie na inne kierunki badań, nie tracąc i próbki i czasu na jej powtórne pobranie i dostarczenie. Podczas ewentualnych konsultacji przed próbkowaniem pracownik laboratorium wskazałby dodatkowo optymalny czas próbkowania, ilość próbek kału (z wyjaśnieniem dlaczego), a poza tym przypomniał o dodatkowych próbkach istotnych w zaistniałym problemie np. o paszy czy wodzie.
Zdarza się, że w zakładanym postępowaniu nie uwzględniamy trywialnego elementu - koszów badań. Jasność w tym zakresie oszczędzi każdemu niepotrzebnych przykrości i nieporozumień. Cenniki są powszechnie dostępne, zawsze też można telefonicznie sprecyzować kosztorys.
1. Będąc na fermie podejmuje się wespół z hodowcą decyzję o podjęciu badań laboratoryjnych. Przyjęte postępowanie zależne jest od wiedzy, łączącej różne gałęzie nauki (hodowla, żywienie, środowisko, nawet uprawa roślin, weterynaria, w tym znajomość technik laboratoryjnych) oraz dostępnych informacji w zakresie konkretnej fermy, z wykorzystaniem dotychczasowych wyników analiz laboratoryjnych.
2. Przed podjęciem ostatecznej decyzji, zaleca się skontaktowanie się z laboratorium, którego pracownicy po przedstawieniu problemu, potwierdzą lub dookreślą zakres próbkowania i dobór próbek (ile, skąd, grupa wiekowa, grupa technologiczna, stan choroby, ukierunkowanie, rodzaj materiału badawczego, uzupełniającego, sposób zabezpieczenia itp.). W wielu przypadkach oszczędzi to środków, a jednocześnie skróci czas dochodzenia.
W większości nieświadomie, całość odpowiedzialności za wynik badania spada na laboratorium. Jednak na końcowy wynik badania, który otrzymujemy z laboratorium składa się,
- analiza laboratoryjna, ale także czynności wstępne, które pozostają poza gestią laboratorium:
1. Na obecnym poziomie technik laboratoryjnych o skuteczności badań laboratoryjnych decyduje... pobór próbek. To nie pomyłka, badanie zaczyna się w tym właśnie momencie. Tu popełnia się błędy, których naprawić już nie sposób, dlatego trzeba poświęcać temu wiele uwagi. Przydaje się tu wiedza zarówno z zakresu oceny środowiska i paszy, technik laboratoryjnych, rachunku prawdopodobieństwa czy znajomości zarządzania stadem, ale przede wszystkim patogenezy, epizootiologii. Próba identyfikacji aktualnego stanu chorobowego na podstawie badań serologicznych wynika z niedopatrzenia, z pośpiechu, wreszcie z zapominania, że pierwsze przeciwciała wykrywalne w rutynowych testach pojawiają się po 7-10 dniach (nawet > 3 tyg). Serologiczne badanie rozpoznawcze w oparciu o 1-2 próbki (pseudo oszczędność) jest pozbawione uzasadnienia statystycznego, a otrzymanego wyniku nie da się ekstrapolować na całą stawkę zwierząt. Dosyłanie „nieświeżych” zwłok kończy się „izolacją” drobnoustrojów o dużej zdolności ruchu i penetrowania tkanek – Proteus, E.coli, Pseudomonas itp.. Czasem w wyniku pośpiechu i niedopatrzenia nie zachowuje się zasady aseptyczności i to nie tylko na etapie pobierania materiału, ale i jego transportu. W dobie tak czułych technik jak PCR, a zwłaszcza Real Time PCR kontakt próbki z brudnym pojemnikiem, rękawicą, narzędziami prowadzi do pojawiania się reakcji dodatnich wskutek zaistniałej kontaminacji. Czułość współczesnych technik zaskakuje. Dość powiedzieć, że w technice RT-PCR możliwe jest wykrycie materiału genetycznego w rozcieńczeniu większym niż 1:300. W wykrywaniu mikotoksyn technikami HPLC (wysokosprawna chromatografia cieczowa) obrazowo rzecz ujmując jesteśmy w stanie wykryć 1 (jedno!) skażone ziarenko orzeszka w całym wagonie orzeszków. Toteż niedbałe czy niezgodne z procedurami próbkowanie zwykle prowadzi do wyniku, którego próba interpretacji prowadzi na manowce.
2. Ukierunkowanie badań – laboratorium podejmuje tylko kierunki badań wskazane pismem przewodnim. Laboratoria prywatne zwykle przechowują powierzony materiał nawet po zakończeniu badań. Możliwe jest zatem dodatkowe zlecenie bez konieczności powtórnego próbkowania i transportu.
3. Opis próbek – niedoceniany, niezwykle istotny element czynności wstępnych. Brak charakterystyki danych nie pozwala na obróbkę statystyczną, traci się zatem uzyskanie dodatkowych, nieodpłatnych informacji. Brak jakichkolwiek danych niekiedy uniemożliwia wręcz podjęcie badań. Przykład: zlecenie badania na mykoplazmozę bez podania gatunku zwierzęcia.
4. Sposób zabezpieczenia próbek – nieodpowiednie zabezpieczenie to nie tylko groźba kontaminacji, przerostów, utraty aktywności badanych parametrów, ale i zagrożenie zdrowia publicznego czy przenoszenia schorzeń zakaźnych do innych obiektów.
5. Czas transportu, warunki transportu – wiele kierunków badań nie może zostać przeprowadzonych, o ile nie zachowa się odpowiednich warunków transportu. W dobie szybkich środków istnieje kilka sposobów przesyłania materiału badawczego:
a. transport własny
b. transport publiczny.
c. kurier
d. własny system logistyczny laboratorium – najbardziej profesjonalny, zabezpieczający odpowiednie warunki, czas dostarczenia, zabezpieczenie próbki w zakresie ochrony zdrowia publicznego. W ramach tras rejsowych – bezpłatny.